来源:宝创日期:2021-12-06(3075)
宫颈癌(Cervical cancer),是亚洲女性的第二大癌症杀手,更是致死率最高的癌症之一。
全球范围内,平均每2分钟就有一名女性死于子宫颈癌,有一半的宫颈癌病例发生在亚洲地区。
2020年中国宫颈癌新发病例近11万,死亡病例近6万,分别约占全球发病和死亡总数的18.3%和17.6%,我国宫颈癌患者约占全球的1/5,防控压力很大。
但宫颈癌也是目前人类所有癌症中,唯一可以通过早期预防的治疗消灭的癌症。
全球范围的研究结果显示,99.7%的宫颈癌与人乳头瘤病毒(Human Papillomavirus,HPV)感染有关,而持续性的高危型HPV感染则是导致宫颈上皮内瘤变及宫颈癌的主要原因[1]。近年来临床通常采用HPV DNA检测作为宫颈癌初筛的方法,但实践发现,HPV DNA检测临床假阳性率偏高,容易引起患者恐慌,且容易导致过度诊断[2]。相关研究发现,HPV E6/E7 mRNA检测临床特异性更高,可以提高筛查效能,使患者受益[3]。
HPV属于乳头瘤病毒科,是一种小分子的环状双链DNA病毒,基因组长约8000碱基对(bp),分为3个功能区,即早期转录区(E区)、晚期转录区(L区)和非转录区(长控制区,LCR),其中E区的E6、E7基因编码两种致癌蛋白,是导致宫颈癌的主要原因[4]。
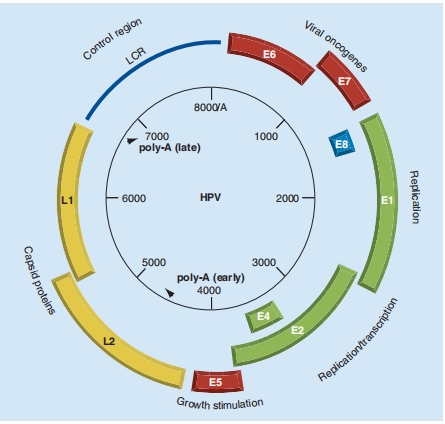
图1:HPV病毒基因组结构
在高危型HPV初始感染阶段,HPV E6/E7基因处于静默期,不表达或低表达HPV E6/E7 mRNA,一般不会产生癌蛋白,宫颈癌发生风险较低,一过性感染大多处于此阶段;当高危型HPV进入持续感染阶段时,HPV E6/E7 mRNA高水平表达,产生癌蛋白,进而逐步发展为癌前病变,直至癌变[5-6]。因此,HPV E6/E7 mRNA是病毒基因活跃状态的关键性标志物,在HPV的致病过程中起着关键的枢纽作用,HPV E6/E7 mRNA检测可以更特异的筛查和分流HPV引起的宫颈高危病变而非一过性感染。
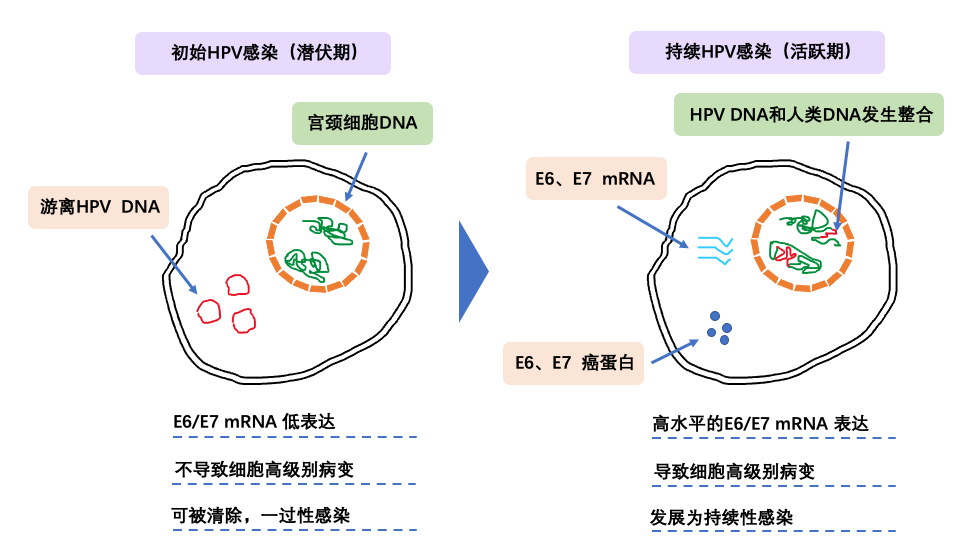
图2:HPV感染过程
筛查出HPV DNA阳性患者如何进行分流很重要。目前细胞学已不是目前唯一的首选分流手段。HPV E6/E7mRNA可从癌基因表达活跃状态层面上分流病毒,不亚于细胞学分流,大量临床研究表明mRNA用于分流HPV DNA 阳性患者是可靠且受益的[7]。
2015年欧洲宫颈癌筛查指南指出,HPV DNA检测HPV病毒基因组是否存在,而HPV E6/E7 mRNA检测与癌症进展相关基因的表达,可以有效降低一过性感染的检出,及时发现宫颈癌发生风险较高的患者,因此HPV E6/E7 mRNA检测可以提供更合适的特异性[8]。
2019年美国阴道镜和宫颈病理学会(American Society for Colposcopy and Cervical Pathology,ASCCP)宫颈癌筛查指南推荐基于风险评估的方式,对不同风险人群采用不同的管理策略,并且支持具备更高特异性的产品用于宫颈癌筛查,其中包括HPV E6/E7 mRNA检测方法[9]。
随着HPV筛查的广泛普及,HPV E6/E7 mRNA在宫颈癌筛查方面的价值得到了更多的研究和论证。多项临床试验对HPV DNA检测和HPV E6/E7 mRNA检测的临床灵敏度和特异性进行了对比研究,研究结果均发现HPV E6/E7 mRNA检测与HPV DNA检测具有相似的敏感性,但HPV E6/E7 mRNA检测特异性更高[10-11]。
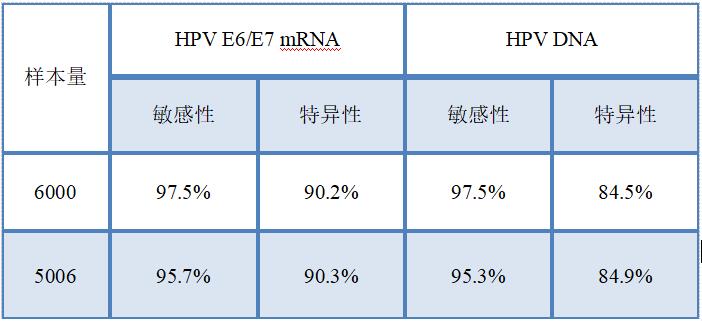
表1:HPV DNA与HPV E6/E7 mRNA临床筛查灵敏度和特异性对比
英国一项研究显示,如果采用HPV E6/E7 mRNA检测替代HPV DNA检测,可以使不必要的阴道镜检查减少28009次,不必要的HPV DNA检测减少90605次,不必要的细胞学检查减少253477次,筛查费用可以节省1500多万英镑[12]。
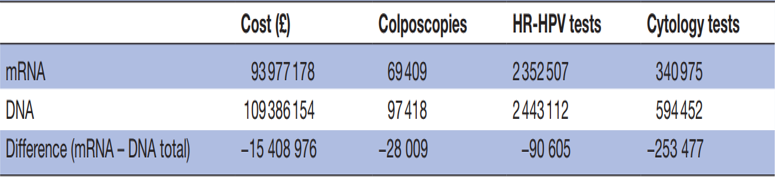
表2:HPV DNA与HPV E6/E7 mRNA临床筛查价值对比
综上所述,HPV E6/E7 mRNA作为指示病毒基因复制转录处于活跃状态的分子标志物,临床检测特异性更高,可以进一步鉴别和筛查有可能发展为癌症的宫颈癌前病变,降低由一过性HPV病毒感染导致的良性病变的检测和过度治疗,减轻患者心理压力,降低患者诊疗成本,使患者受益。
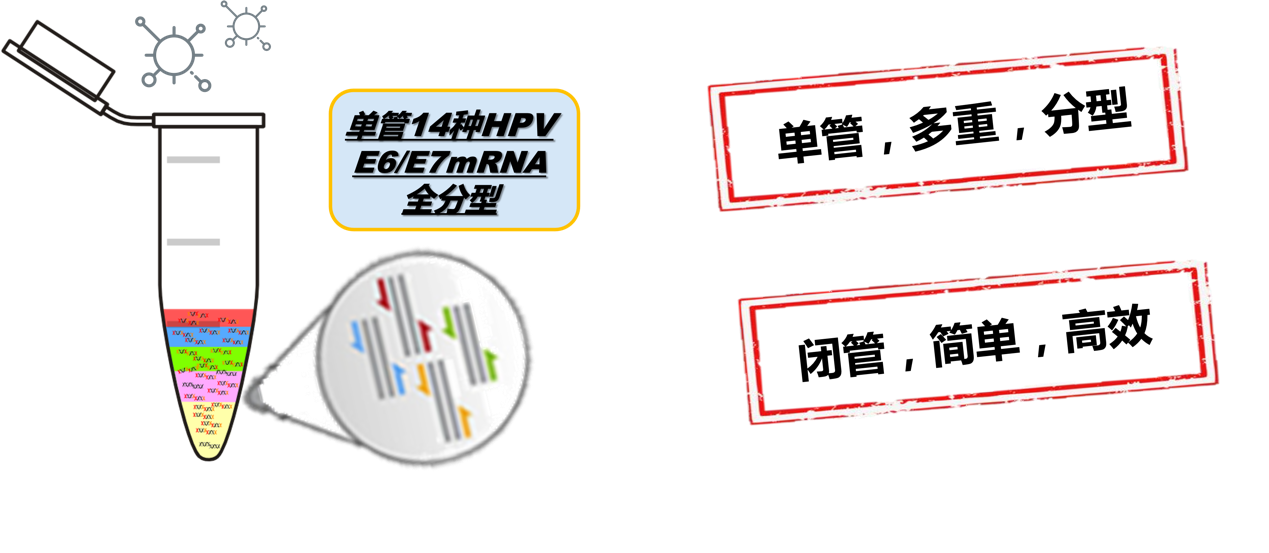
公司产品采用MPA检测技术,单管内检测HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68型共14种高危型HPV E6/E7mRNA,是国内首款单管区分14种HPV E6/E7 mRNA的产品。
具有如下优势:
1、检测灵敏度不高于100拷贝/反应。
2、操作便捷,从样本提取到获得检测报告时长不超过3小时。
3、兼容常规4通道荧光PCR仪
4、软件智能判读结果
5、设计了人源性质控,且质控检测基因是RNA,可对加样、逆转录、扩增及样本质量进行全程监控。
1) 国家药品监督管理局. 人乳头瘤病毒(HPV)核酸检测及基因分型、试剂技术审查指导原则(2015年第93号通告).
2) Li Liu,et al.Role of E6/E7 mRNA in discriminating patients with high-risk human papilloma virus-positive associated with cytology-negative and atypical squamous cells of undetermined significance[J].Biomedical Research . 2017,28(9):3986-3990.
3) Mockel J,et al. Human Papillomavirus E6/E7 mRNA testing has higher specificity than liquid-based DNA testing in the evaluation of cervical intraepithelial neoplasia. Anal Quant Cytol Histol. 2011 Dec;33(6):311-5.
4) Lie AK, et al. Human papillomavirus E6/E7 mRNA testing as a predictive marker for cervical carcinoma. Expert Rev Mol Diagn. 2008 Jul;8(4):405-15.
5) M Thomas, et al. Human papillomaviruses, cervical cancer and cell polarity [J] .Oncogene (2008) 27, 7018–7030.
6) 胡家昌. 高危型HPV DNA与宿主基因整合及致癌机理的相关研究进展. 现代妇产科进展, 2015, 24(5):384-386.
7) 2015 European guidelines for quality assurance in cervical cancer screening P62.
8) 2019 ASCCP Risk-Based Management Consensus Guidelines for Abnormal Cervical Cancer Screening Tests and Cancer Precursors .
9) J Cuzick, et al. Comparing the performance of six human papillomavirus tests in a screening population[J]. British Journal of Cancer, 2013.
10) Monsonego J , et al. Risk assessment and clinical impact of liquid-based cytology, oncogenic human papillomavirus (HPV) DNA and mRNA testing in primary cervical cancer screening (The FASE Study)[J]. Gynecologic Oncology, 2012, 125(1):175-180.
11) Weston G , Dombrowski C , Harvey M J , et al. Original research: Use of the Aptima mRNA high-risk human papillomavirus (HR-HPV) assay compared to a DNA HR-HPV assay in the English cervical screening programme: a decision tree model based economic evaluation[J]. BMJ Open, 2020, 10(3).